En el marco de los Coloquios de Físicas 2016-1, organizados por la Sección de Física de la PUCP, compartimos, con todos aquellos interesados en participar, la sumilla de la ponencia el Dr. Marvin J. Bayro (National Institutes of Health, EE.UU)
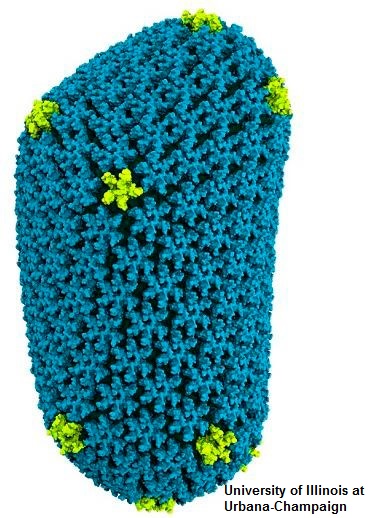
La proteína cápside del núcleo del virus del SIDA se auto-ensambla espontáneamente in vitro y forma tubos con una red hexagonal idéntica a la que se encuentra en partículas auténticas del virus. En esta presentación, describiré la aplicación de la resonancia magnética nuclear (RMN) en el estado sólido para el estudio de ensamblajes de la proteína cápside del VIH. Innovaciones en este método espectroscópico proporcionan información nueva sobre la estructura molecular de la proteína en el estado ensamblado, la dinámica molecular dentro de la red, y los mecanismos estructurales para la formación de la partícula del virus. Esta información está contenida en la asignación de señales en los espectros de RMN, los desplazamientos químicos correspondientes, y mediciones cuantitativas de acoplamientos dipolares en la proteína. Estos estudios demuestran el poder y la versatilidad de la espectroscopía de RMN en estado sólido para caracterizar grandes ensamblajes de proteínas a nivel atómico.
Martes 22 de marzo a las 2 p.m.
Auditorio de Física
Ingreso Libre previa inscripción aquí